Alzheimer und eine ungewöhnliche „Anstandsdame“
Forschungsteam der Universität Konstanz und Universität Utrecht entschlüsselt den Mechanismus der Zusammenlagerung des Alzheimer-Proteins Tau
Zu den Hauptmerkmalen der Alzheimer-Krankheit zählen die sogenannten Alzheimer-Fibrillen: Ablagerungen des Proteins Tau, die sich in Nervenzellen als Fasern ansammeln und die Kommunikation zwischen Nervenzellen stören. Wie aber kommt es zu dieser Faserbildung? Warum entstehen aus dem eigentlich nützlichen Protein Tau, das üblicherweise Zellen stabilisiert, solch schädliche Ablagerungen? Dieser Frage ging ein Forschungsteam der Universität Konstanz und der Universität Utrecht (Niederlande) unter Federführung des Konstanzer Chemikers Prof. Dr. Malte Drescher nach. Mittels Strukturanalysen deckten die Forschenden einen überraschenden biochemischen Mechanismus auf, in dem ein sogenanntes Chaperon (französisch „Anstandsdame“, ein Helferprotein) eine ungewöhnliche Rolle spielt.
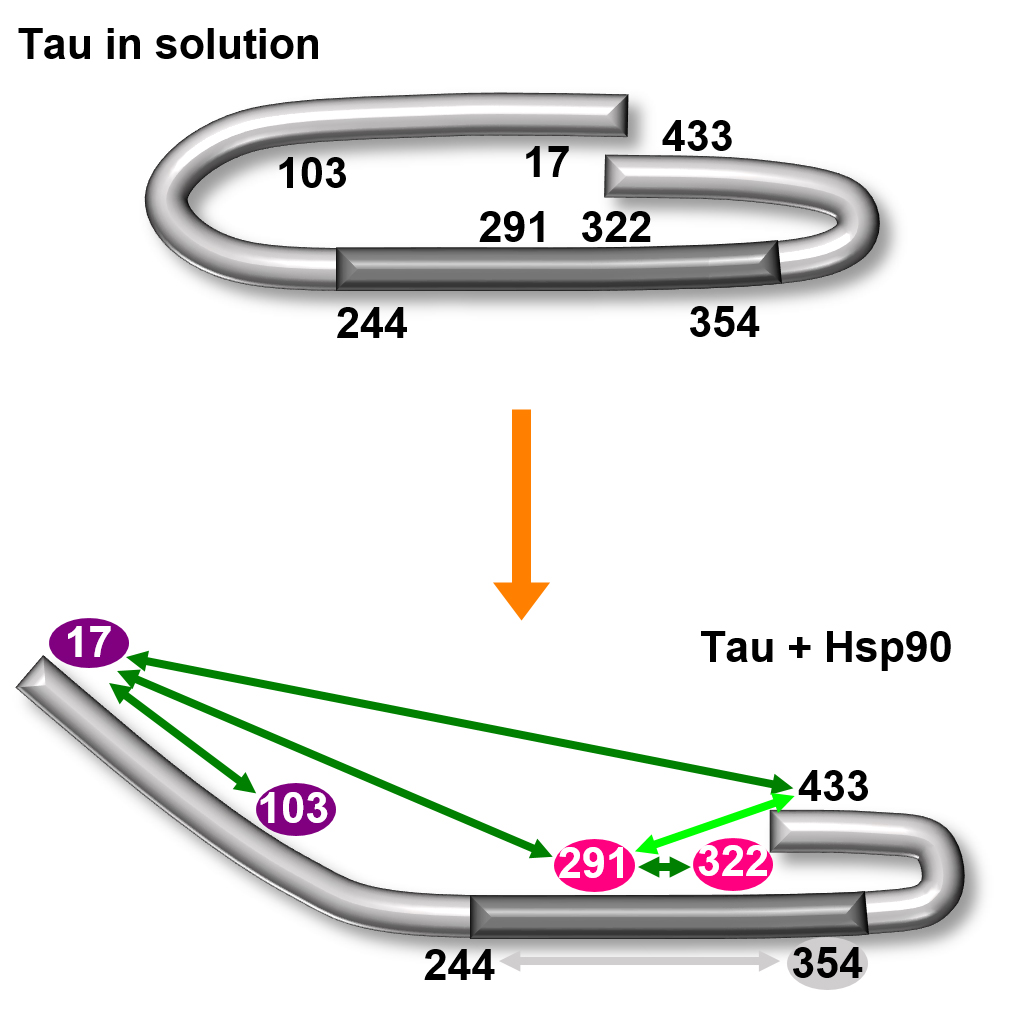
Anders als die meisten Proteine hat Tau keine eindeutig festgelegte Struktur: Tau ist ein „intrinsisch ungeordnetes Protein“, das viele Formen annehmen kann. „Wir können es uns wie bei einem Seil vorstellen: Es kann mal langgestreckt, mal gebogen, mal in sich geschlungen sein“, schildert Malte Drescher. Trotz aller Varianz hat Tau die Tendenz, eine charakteristische, in sich gebogene Struktur anzunehmen, vergleichbar mit der Form einer Büroklammer.
Eine ungewöhnliche „Anstandsdame“
Eine Besonderheit tritt auf, sobald das Chaperon HSP-90 („Heat-Shock-Protein 90“) auf Tau trifft. „Chaperone sind üblicherweise dafür zuständig, neu produzierte Proteine in die richtige Form zu bringen. Diese ‚Anstandsdamen‘ üben folglich eine Helferfunktion bei der Strukturbildung von Proteinen aus. Wir hatten uns gefragt: Was könnte ihre Helferfunktion bei einem intrinsisch ungeordneten Protein wie Tau sein?“, resümiert Drescher.
Mittels Strukturanalysen konnten Drescher und sein Team zeigen, dass das Chaperon eine Öffnung der Büroklammer-Formation von Tau bewirkt: Es klappt die „Bügel“ der Büroklammer nach außen. „Der Bereich in der Mitte der Büroklammer wird dadurch freigelegt und zugänglich. Von diesem Bereich ist bekannt, dass er für die Aggregation zuständig ist, also für die Anheftung von weiteren Tau-Proteinen an das Molekül“, erläutert die Biophysikerin Sabrina Weickert, Erstautorin der Studie und Doktorandin an der Professur von Malte Drescher. In ihrer aufgeklappten Form können sich Tau-Moleküle folglich passgenau aufeinanderschichten (Oligomerisierung).
„Diese Oligomerisierung durch HSP-90 war sehr überraschend“, führt Malte Drescher aus: „Ein Chaperon ist eigentlich für genau das Gegenteil zuständig: Es soll ein Protein in eine definierte Form bringen und auf gar keinen Fall dazu beitragen, dass es einen ‚Proteinhaufen‘ bildet“, so Drescher.
Für Alzheimer verantwortlich oder insgeheim ein Abwehrmechanismus?
Ist die Anwesenheit des Chaperons folglich eine Voraussetzung für die Bildung von Alzheimer-Fibrillen? Verursacht ausgerechnet die „Anstandsdame“ letzten Endes die Entstehung der Alzheimer-Krankheit? Die Forscherinnen und Forscher werden dieser Frage in weiteren Studien nachgehen. Malte Drescher vermutet jedoch einen genau gegensätzlichen Effekt: „Ich würde genau andersherum argumentieren: Es könnte sich sogar um einen Trick des Körpers handeln, um Alzheimer zu verhindern“, überlegt Drescher. Die Tau-Oligomere, die durch HSP-90 entstehen, weisen nämlich eine entscheidende Besonderheit auf: Sie wachsen nicht weiter zu den typischen ausgeprägten Alzheimer-Fibrillen.
„Die Oligomerisierung durch HSP-90 könnte möglicherweise ein Abwehrmechanismus sein, in dem das Chaperon die Tau-Proteine in die Form von kleinen Oligomer-Schichtungen zwingt. Das ist zwar nicht günstig, verhindert aber effektiv, dass sich längere, Alzheimer-typische Fibrillen bilden“, stellt Drescher zur Diskussion. Sollte sich diese Vermutung bewahrheiten, bliebe das Chaperon seinem Titel als „Anstandsdame“ treu: Es verhinderte in diesem Fall die Entstehung langer Alzheimer-Fibrillen, indem es ein „Bauernopfer“ eingeht und Tau in kleineren, ungefährlicheren Aufschichtungen bindet.
Spin-Marker
Das Protein Tau ist nur wenige Nanometer groß, also das Milliardstel eines Meters, und für das bloße Auge oder Lichtmikroskope nicht sichtbar. Sonst typische Experimente zur Strukturbestimmung wie die Röntgenstrukturanalyse scheitern, da Tau als intrinsisch ungeordnetes Protein so extrem flexibel ist. Um trotzdem die Strukturveränderungen des Proteins zu bestimmen, griffen die Forscherinnen und Forscher daher auf eine versierte Methode zurück: Sie brachten kleinste Sondenmoleküle, sogenannte Spin-Marker, an Schlüsselpositionen des Moleküls an, darunter die äußeren „Bügel“ der Büroklammer-Formation. „Die Sonden sind magnetisch und spüren sich gegenseitig. Wir messen die Wechselwirkung zwischen den Sonden und können daraus den Abstand zwischen ihren Positionen bestimmen“, erläutert Malte Drescher. Auf diese Weise können sie indirekt die Formation des Moleküls sowie seine Strukturveränderungen erfassen.
Die Experimentreihe fand in vitro statt, mit aufgereinigten Tau- und HSP-90-Molekülen im Reagenzglas. „Wir möchten das Experiment nun in die Zelle bringen, um den biochemischen Mechanismus unter den realen Bedingungen einer Zelle zu beobachten“, gibt Malte Drescher einen Ausblick auf kommende Forschungsarbeit. Langfristiges Ziel ist, die Entstehung der Alzheimer-Krankheit besser zu verstehen und Methoden zu finden, um sie zu verhindern.
Die Forschungsarbeiten fanden im Rahmen des Konstanzer Sonderforschungsbereiches 969 „Chemische und biologische Prinzipien der zellulären Proteostase“ statt.
Faktenübersicht:
- Originalpublikation: Sabrina Weickert, Magdalena Wawrzyniuk, Laura John, Stefan G. D. Rüdiger, Malte Drescher, The molecular mechanism of Hsp90-induced oligomerization of Tau, DOI: https://doi.org/10.1101/614289
- Strukturanalysen des Tau-Moleküls und dessen Aggregation zu sogenannten Alzheimer-Fibrillen.
- Das Chaperon (frz. „Anstandsdame“) HSP-90 bewirkt, dass das Tau-Protein seine charakteristische „Büroklammer-Formation“ auseinanderklappt. Der für Aggregation zuständige Mittelbereich des Moleküls wird dadurch zugänglich und eine Aufeinanderschichtung (Oligomerisierung) von Tau-Molekülen tritt ein.
- Weitere Forschungsarbeiten sollen klären, ob diese Aufschichtung eine Voraussetzung für die Alzheimer-Krankheit oder vielmehr ein biologischer Abwehrmechanismus ist.
- Kooperationsprojekt der Universität Konstanz und der Universität Utrecht (Niederlande) unter Federführung von Prof. Dr. Malte Drescher, Prorektor für Forschung und wissenschaftlichen Nachwuchs sowie Professor für Physikalische Chemie an der Universität Konstanz.
- Die Forschung fand im Rahmen des Sonderforschungsbereiches 969 „Chemische und biologische Prinzipien der zellulären Proteostase“ an der Universität Konstanz statt und wurde von der Deutschen Forschungsgemeinschaft (DFG) gefördert.
